

アルツハイマー病を早期発見するPET(ポジトロン断層撮影)の現況
2011年にアメリカでアルツハイマー病の診断ガイドラインが27年ぶりに改訂されました。以前は認知症段階しか定義されていなかったのですが、以下のように分類されました。
① 認識機能は正常だが、脳内のアミロイドβの蓄積が始まっている段階
(プレクリニカル アルツハイマー病という診断名)
② 経度の問題が表面化するが、日常生活に支障ない段階
③ 明確な症状が表れ脳内で変化が起きている段階
(現在、治療薬の治験が実施されている対象)
これまで上記③のアルツハイマー病患者を対象に、コリンエステラーゼ(3種類)、グルタミン酸受容体チャンネル過剰機能抑制剤(1種類)、およびヒト化抗体β―アミロイドペプチドなどのアルツハイマー病認知症状改善薬が上市され、また臨床試験が実地されてきました。
しかしながら、認知症改善が一時的に見られたものの現時点では、薬物治療でアルツハイマー病の進行スピードダウンまたは機能障害を起こした脳を元どおりにすることは不可能な治療実態です。
その理由として、医学的に神経細胞が相当抜け落ち、認知症の症状が出てからは、アルツハイマー病の原因物質であるアミロイドβの蓄積を阻害しても治療が遅すぎるのではないかという医学的な見解が出ています。
アルツハイマー病治療の最先端では、まだ症状が全くなくても将来発病しそうな①のプレクリニカル アルツハイマー病を対象に、脳の病変を早期に診断しその進行を遅らせる評価に注目が集まっています。
そのために強力なバイオマーカーの確立が必要であり、18F-FDG(フルオロデオキシグルコース)をPET検査薬剤とするFDG-PET検査ではグルコース消費量、酸素消費量によって脳疾患の病理や微小な腫瘍の発見に強力な画像診断を提供しています。
また、アミロイドPET画像診断(11C-PIB)ではプレクリニカルステージにある、認知傷害のない症例でアミロイドβが発見されたことから(認知傷害患者に比べアミロイドβ蓄積が少ないが)、アルツハイマー病の進行を予測するバイオマーカーとして有効であることが確認されています。
癌の診断にきわめて有用なPET検査
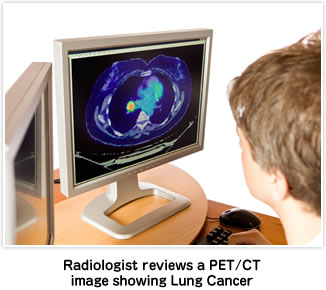
PET検査は、癌細胞が正常細胞に比べて3~8倍のブドウ糖を取組むという性質を利用し、ブドウ糖に近い成分18F-FDGを体内に注射し、しばらくしてから全身をPETで撮影します。
ブドウ糖、18F-FDGが多く集まることが、癌を発見する手がかりとなります。
従来までのX線、CTおよびMRIの検査は、写し出された造形から癌を見つけますが、PETは細胞の性質を調べて癌を探し出します。
このようにPET検査は診療に極めて有用な検査法であることが、これまでの多くの臨床研究により確認され、平成14年には癌を中心とする12疾患(てんかん、虚血性心疾患、肺癌、乳癌、大腸癌、頭頸部癌、悪性リンパ腫、悪性黒色腫、脳腫瘍、膵癌、移転性肝癌、原発不明癌)に対するFDG-PETが健康保険診療として採用されました。
また、平成18年の診療報酬改定では新たに食道癌、卵巣癌および子宮癌が適用疾患として追加されました。
平成17年には、放射性医薬品製造販売会社が薬事法に基づく放射性医薬品としての18F-FDGの製造販売承認を取得し、18F-FDGを医薬品として販売が開始されました。
また、PET検査・PET/CT(コンピュータ断層撮影)が新たに定められ、PETおよびPET/CT検査が安全に適正に施行されるため、人員、施設、検査方法などの法令、規則およびガイドラインも整備されてきました。
承認申請の開発支援コンサルティングを提供します
放射性医薬品の承認申請のための国際共通資料としてのCTDのうち、
品質に関する文書について開発支援コンサルティングをいたします。
- ・Module 2.3 原薬(品質に関する概括資料)
- ・Module 3.2 原薬(品質に関する文書)
- ・Module 2.3 製剤(品質に関する概括資料)
- ・Module 3.2 製剤(品質に関する文書)
2.開発支援コンサルティング内容(FAQ)
2-1
上記対象資料の記載内容に関する適格性および整合性の評価検討をGap Analysisの手法を用い、品質保証をいたします。
特に国外資料については、国内での評価後に海外の放射性医薬品CMC担当者と、同時に記載内容について適格性および整合性の評価をグローバルベースで確認いたします。必要に応じ英語での国際電話会議に参加いたします。
また、国内INDおよび承認申請時には各資料の翻訳もいたします。
2-2
国内放射性医薬品会社様のPMDA製造販売承認申請に際しては、日本語で原薬の品質に関する概括資料および品質に関する文書、ならびに製剤の品質に関する概括資料および品質に関する文書を作成いたします。